KEYTRUDA® en association avec LENVIMA® est indiqué :
- pour le traitement des adultes atteints d’un AR à un stade avancé (ne se prêtant pas à une chirurgie curative ou à la radiothérapie) ou métastatique qui n’ont jamais reçu un traitement à action générale contre un AR métastatique.
Déclaration de consensus du Réseau de recherche sur le cancer du rein du Canada (RRCRC) 20213
Chez les patients non traités présentant un adénocarcinome rénal à cellules claires à un stade avancé et un risque favorable, intermédiaire ou défavorable (selon l’IMDC), le pembrolizumab en association avec le lenvatinib est recommandé comme option thérapeutique à privilégier
Voir la recommandation complète émise dans les lignes directrices du RRCRC.
Lignes directrices de pratique clinique du National Comprehensive Cancer Network (NCCN) pour le cancer du rein (NCCN Guidelines®)5
Chez les patients atteints d’un adénocarcinome rénal de stade IV, le pembrolizumab en association avec le lenvatinib est recommandé comme option de choix en première intention dans tous les groupes à risque favorable, intermédiaire ou défavorable.
Veuillez consulter les lignes directrices pour connaître les recommandations complètes.
Étude clinique
Étude KEYNOTE-581/CLEAR : étude clinique chez des patients atteints d’un adénocarcinome rénal à un stade avancé ou métastatique.
ÉTUDE KEYNOTE-581/CLEARKEYTRUDA® en association avec LENVIMA® : posologie recommandée
Pour les adultes atteints d’un adénocarcinome rénal à un stade avancé ou métastatique et qui n’ont pas déjà reçu de traitement à action générale contre ce cancer au stade métastatique1,2
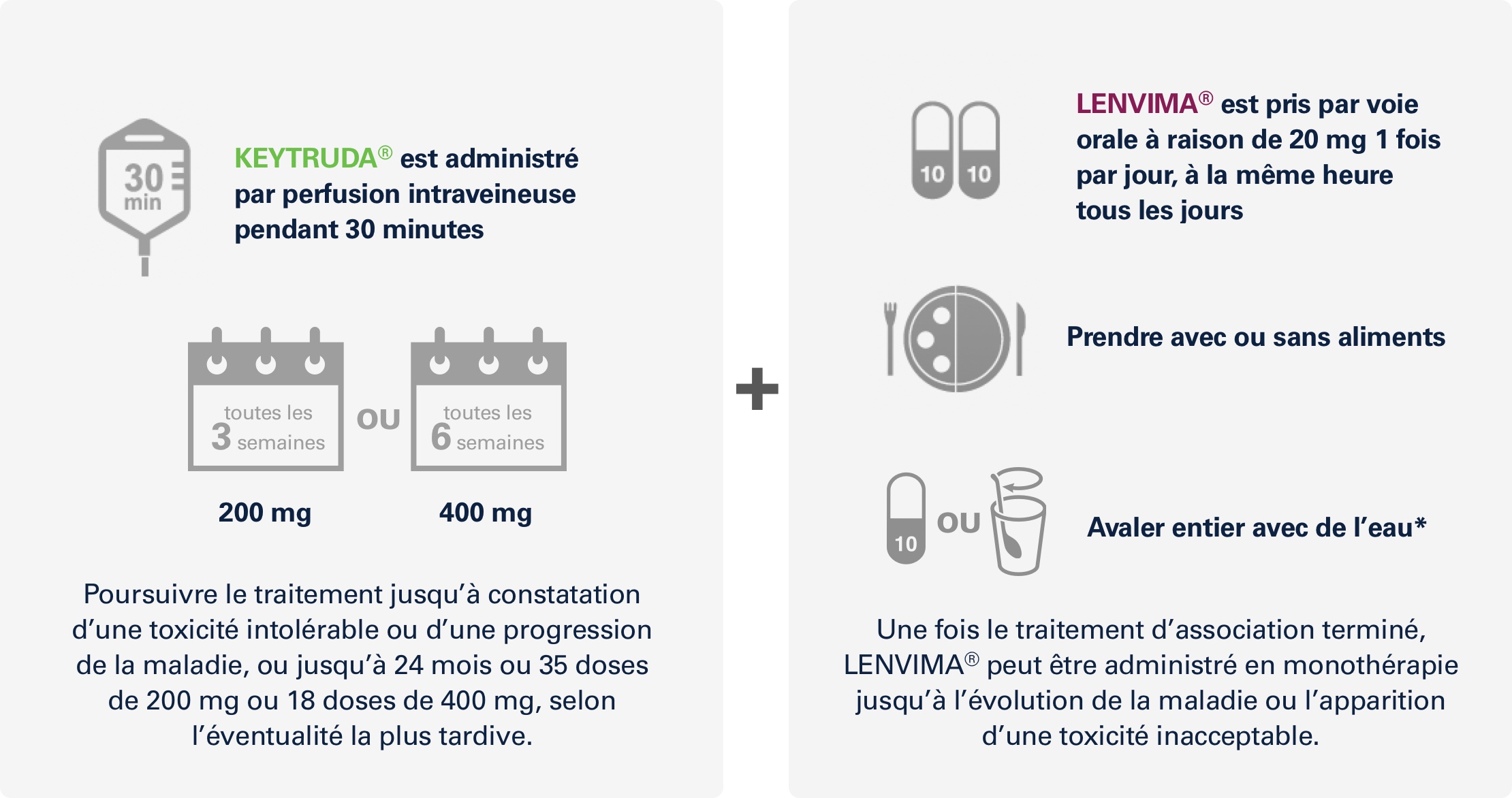
Une prise en charge médicale optimale (traitement ou autres mesures) pour les nausées, les vomissements et la diarrhée doit être mise en œuvre avant toute interruption de l’administration ou réduction de la dose de LENVIMA®; il faut traiter activement la toxicité gastro-intestinale en vue de réduire le risque d’apparition d’une insuffisance rénale ou d’une altération de la fonction rénale2.
Il faut vérifier les taux d’électrolytes, d’enzymes hépatiques et de protéines dans l’urine de même que la fonction thyroïdienne et la tension artérielle avant le début du traitement par LENVIMA® et les surveiller périodiquement par la suite pendant un traitement par LENVIMA®2.
Les fournisseurs de soins ne doivent pas ouvrir la capsule LENVIMA®, car l’exposition répétée au contenu de celle-ci doit être évitée2.
Modification de la dose
Lorsque LENVIMA® est administré en association avec KEYTRUDA®, l’administration d’un des médicaments ou des deux peut être interrompue, la dose de LENVIMA® peut être réduite ou le traitement par LENVIMA® peut être arrêté, en cas de besoin. Le traitement par KEYTRUDA® doit être suspendu ou arrêté conformément aux renseignements contenus dans la monographie du produit. Aucune réduction de la dose de KEYTRUDA® n’est recommandée.1,2
Veuillez consulter la monographie du produit pour connaître les renseignements complets concernant la posologie et l’administration.
KEYTRUDA® en association avec LENVIMA® : outils de prise en charge des effets indésirables
Téléchargez ce guide pour obtenir des conseils sur la prise en charge des effets indésirables chez les patients traités par KEYTRUDA® en association avec LENVIMA®.
Aidez vos patients prenant KEYTRUDA® en association avec LENVIMA® à faire le suivi de leurs effets indésirables en leur remettant ce journal personnel.
LHc = lymphome de Hodgkin classique; LMPCB = lymphome médiastinal primitif à cellules B; IMDC = International Metastatic RCC Database Consortium.
* Les capsules LENVIMA® peuvent aussi être ajoutées, sans être brisées ni écrasées, à une cuillerée à soupe d’eau ou de jus de pommes dans un petit verre pour être mises en suspension. Elles doivent être laissées dans le liquide pendant au moins 10 minutes et brassées pendant au moins 3 minutes pour que leur enveloppe puisse se dissoudre. La suspension doit être avalée. Après l’ingestion, la même quantité d’eau ou de jus de pommes (une cuillerée à soupe) doit être ajoutée dans le verre et agitée quelques fois. Cette quantité additionnelle de liquide doit être avalée2
Références :
- Merck Canada Inc. Monographie de KEYTRUDA®, 21 mars 2024.
- Eisai Limitée. Monographie de LENVIMA®, 19 juillet 2023.
- Canil C et al. Management of advanced kidney cancer: Kidney Cancer Research Network of Canada (KCRNC) consensus update 2021. Can Urol Assoc J. 2021;15(4):84‒97.
- Le Conseil médical du Canada. Analyse de laboratoire – Valeurs de référence. Accessible à l’adresse https://mcc.ca/fr/examens-et-evaluations/ressources-pour-aider-a-la-preparation-dun-examen/valeurs-de-reference/. Consulté le 19 avril 2023.
- NCCN Clinical Practice Guidelines in Oncology. Kidney Cancer, Version 2.2024.
- Motzer R et al. Lenvatinib plus Pembrolizumab or Everolimus for Advanced Renal Cell Carcinoma. N Engl J Med. 2021;384(14):1289-1300. doi: 10.1056/NEJMoa2035716
CA-KLH-00055
