KEYTRUDA® en association avec LENVIMA® pour le traitement de l’adénocarcinome rénal à un stade avancé ou métastatique
-
Explorez KEYTRUDA® en association avec LENVIMA® dans l’étude KEYNOTE-581/CLEAR pour le traitement des patients adultes atteints d’un adénocarcinome rénal à cellules claires à un stade avancé ou métastatique, n’ayant jamais reçu de traitement à action générale contre un adénocarcinome rénal métastatique
Étude KEYNOTE-581/CLEAR : étude contrôlée par comparateur actif menée auprès de patients atteints d’un adénocarcinome rénal à cellules claires à un stade avancé ou métastatique, n’ayant jamais reçu de traitement à action générale contre un adénocarcinome rénal métastatique1
Aperçu de l’étude
- Étude ouverte multicentrique, à répartition aléatoire et contrôlée par comparateur actif
- Comprenait 1 069 patients atteints d’un adénocarcinome rénal à cellules claires à un stade avancé ou métastatique6
KEYNOTE-581/CLEAR :
 D’après les monographies de KEYTRUDA® et de LENVIMA®.
D’après les monographies de KEYTRUDA® et de LENVIMA®.L’utilisation de LENVIMA® en association avec l’évérolimus chez les patients atteints d’un adénocarcinome rénal ayant déjà été traités n’est pas une indication approuvée pour les adultes atteints d’un adénocarcinome rénal à un stade avancé (ne se prêtant pas à une chirurgie curative ou à la radiothérapie) ou métastatique qui n’ont jamais reçu un traitement à action générale contre ce cancer au stade métastatique. L’administration de KEYTRUDA® en association avec LENVIMA® au-delà des critères RECIST de progression de la maladie n’est pas approuvée; selon la section sur la posologie recommandée de KEYTRUDA® en association avec LENVIMA®, le traitement doit être arrêté en cas de progression de la maladie.
ÉTUDE KEYNOTE-581/CLEAR : Les caractéristiques initiales étaient généralement comparables chez les 1 069 patients1,2
 D’après les monographies de KEYTRUDA® et de LENVIMA®.1 f.p.j. = une fois par jour; ECII = évaluation centralisée indépendante menée à l’insu; MSKCC = Memorial Sloan Kettering Cancer Center; PD-L1 = ligand 1 de mort cellulaire programmée; RECIST = Response Evaluation Criteria in Solid Tumours (critères d’évaluation de la réponse tumorale dans les tumeurs solides).
D’après les monographies de KEYTRUDA® et de LENVIMA®.1 f.p.j. = une fois par jour; ECII = évaluation centralisée indépendante menée à l’insu; MSKCC = Memorial Sloan Kettering Cancer Center; PD-L1 = ligand 1 de mort cellulaire programmée; RECIST = Response Evaluation Criteria in Solid Tumours (critères d’évaluation de la réponse tumorale dans les tumeurs solides).
* Amérique du Nord vs l’Europe occidentale vs le « reste du monde ».
† Risque favorable vs intermédiaire vs défavorable.§ Comprend une hypothyroïdie, une augmentation de l’hormone thyréotrope dans le sang et une hypothyroïdie secondaire.1
¶ Comprend une diarrhée et une gastroentérite.1
** Comprend les effets suivants : ulcère aphteux, douleur gingivale, glossite, glossodynie, ulcère buccal, inflammation des muqueuses, gêne buccale, vésicules de la muqueuse buccale, douleur buccale, douleur oropharyngée, inflammation pharyngée, stomatite.1
†† Comprend un inconfort abdominal, une douleur abdominale, une rigidité abdominale, une sensibilité abdominale, un malaise épigastrique, une douleur au bas de l’abdomen, une douleur dans le haut de l’abdomen.1
‡‡ Comprend une asthénie, une fatigue, une léthargie et un malaise.1
§§ Comprend une augmentation de l’alanine aminotransférase, une augmentation de l’aspartate aminotransférase, une augmentation de la bilirubine sanguine, une atteinte hépatique provoquée par un médicament, une augmentation des enzymes hépatiques, une insuffisance hépatique, une fonction hépatique anormale, une lésion hépatocellulaire, une hépatotoxicité, une hyperbilirubinémie, une hypertransaminasémie, une hépatite à médiation immunitaire, une hausse des paramètres des tests de la fonction hépatique, une lésion hépatique, une augmentation du taux de transaminases, une augmentation des gamma-glutamyltransférases.1
¶¶ Comprend une diminution de l’appétit et une satiété précoce.1
*** Comprend une arthralgie, une arthrite, une douleur au dos, des douleurs osseuses, des douleurs mammaires, une douleur musculosquelettique thoracique, des malaises musculosquelettiques, des douleurs musculosquelettiques, une raideur musculosquelettique, une myalgie, une douleur au cou, une douleur thoracique non cardiaque, une douleur aux extrémités, une douleur à la mâchoire1
††† Comprend une hémoglobinurie, un syndrome néphrotique et une protéinurie1.
‡‡‡ Comprend une atteinte rénale aiguë, une azotémie, une hausse de la créatininémie, une diminution de la clairance rénale de la créatinine, une hypercréatininémie, une insuffisance rénale, un dysfonctionnement rénal, une oligurie, une diminution du débit de filtration glomérulaire et une néphropathie toxique.1
§§§ Comprend une éruption cutanée dans la région génitale, une éruption cutanée au point de perfusion, une éruption cutanée pénienne, une éruption cutanée périnéale, une éruption cutanée, une éruption érythémateuse, une éruption maculaire, une éruption maculopapuleuse, une éruption papuleuse, une éruption prurigineuse, une éruption pustuleuse.1
¶¶¶ Comprend un érythème palmaire, une érythrodysesthésie palmo-plantaire et un érythème plantaire.1
**** Comprend une hypertension essentielle, une hausse de la tension artérielle, une hausse de la tension artérielle diastolique, une hypertension, une crise hypertensive, une rétinopathie hypertensive, une tension artérielle instable1.
†††† Comprend tous les termes relatifs aux hémorragies. Les effets indésirables liés aux hémorragies survenus chez au moins un sujet dans l’un ou l’autre des groupes de traitement sont les suivants : hémorragie anale, rupture d’anévrisme, vésicule sanguine, anémie attribuable à la perte de sang, hématurie, hématome au point d’entrée du cathéter, microhémorragies cérébrales, hémorragie conjonctivale, contusion, diarrhée hémorragique, coagulation intravasculaire disséminée, ecchymose, épistaxis, hémorragie oculaire, hémorragie gastrique, gastrite hémorragique, saignement gingival, hémorragie des voies urinaires, hémothorax, hématémèse, hématome, hématochézie, hématurie, hémoptysie, hémorroïdes hémorragiques, tendance accrue aux ecchymoses, hématome au point d’injection, hémorragie au point d’injection, hémorragie intra-abdominale, hémorragie gastro-intestinale basse, syndrome de Mallory-Weiss, méléna, pétéchie, hémorragie rectale, hémorragie rénale, hémorragie rétropéritonéale, hémorragie de l’intestin grêle, hémorragies linéaires sous-unguéales, hématome sous-cutané, hématome sous-dural, hémorragie méningée, purpura thrombopénique thrombotique, hémorragie tumorale, hématome traumatique, hémorragie digestive haute1.KEYTRUDA® en association avec LENVIMA® vs le sunitinib
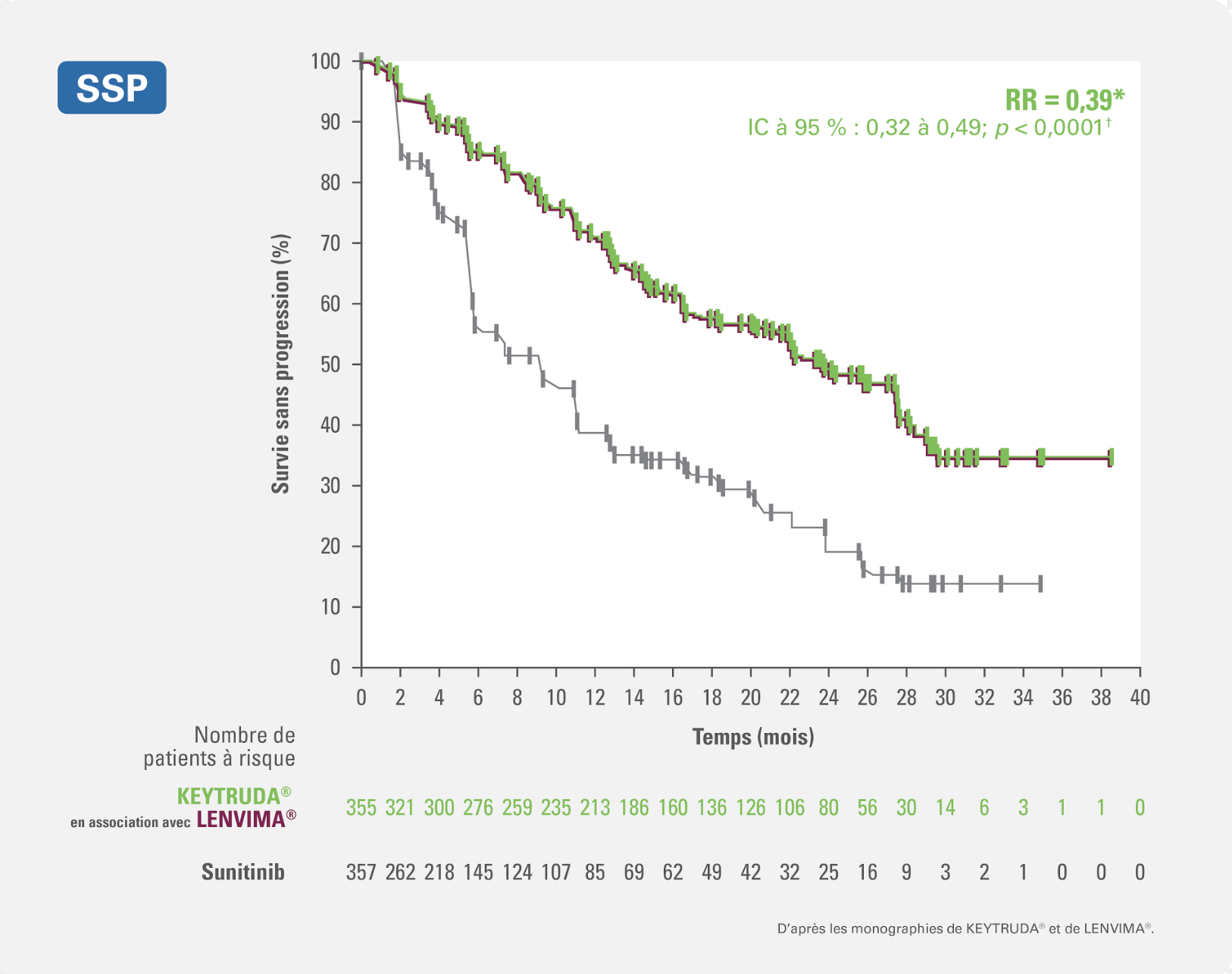
Survie sans progression
KEYTRUDA® in association avec LENVIMA® a entraîné des améliorations significatives quant à la survie sans progression (paramètre d’évaluation principal), vs le sunitinib, chez les patients atteints d’un adénocarcinome rénal à un stade avancé ou métastatique et n’ayant jamais reçu de traitement à action générale contre un adénocarcinome rénal1,2
Réduction de 61 % du risque de progression ou de décès avec KEYTRUDA® en association avec LENVIMA® vs le sunitinib (RR=0,39* [IC à 95% : 0,32 à 0,49; p<0.0001†])
Courbe de Kaplan-Meier de la survie sans progression avec KEYTRUDA® en association avec LENVIMA® (n = 355) vs le sunitinib (n = 357)1,2
 D’après les monographies de KEYTRUDA® et de LENVIMA®.
D’après les monographies de KEYTRUDA® et de LENVIMA®.KEYTRUDA® en association avec LENVIMA®1,6
45 %
(160 patients sur 355 ayant présenté un événement)Sunitinib1,6
57 %
(205 patients sur 357 ayant présenté un événement)La SSP médiane était de 23,9 mois [IC à 95 % : 20,8 à 27,7] avec KEYTRUDA® en association avec LENVIMA®.
La SSP médiane était de 9,2 mois [IC à 95 % : 6,0 à 11,0] avec le sunitinib1,2.Survie globale
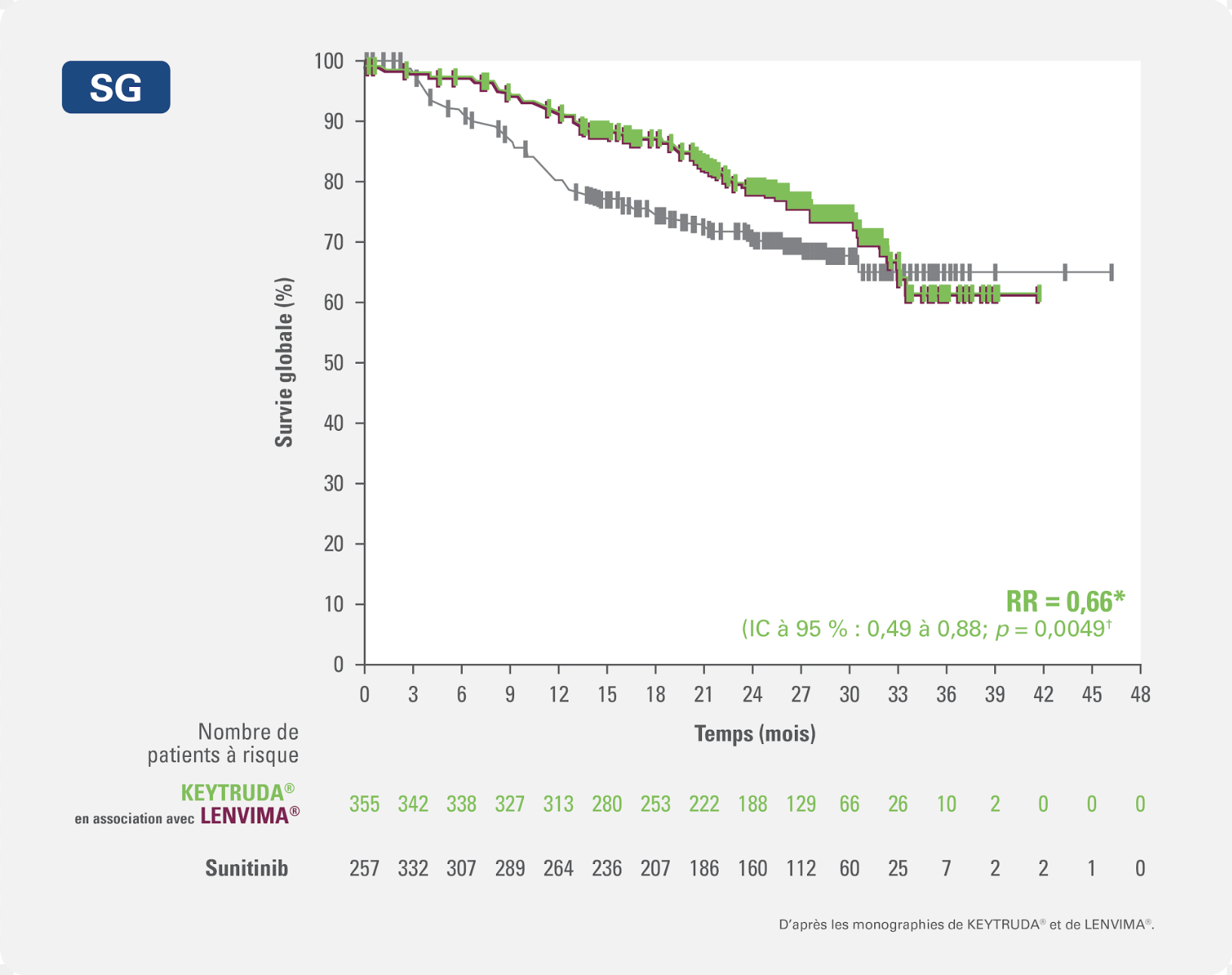
KEYTRUDA® en association avec LENVIMA® a entraîné des améliorations significatives quant à la survie globale (paramètre d’évaluation secondaire), vs le sunitinib, chez les patients atteints d’un adénocarcinome rénal à un stade avancé ou métastatique et n’ayant jamais reçu de traitement à action générale contre un adénocarcinome rénal1,2
Réduction de 34 % du risque de décès avec KEYTRUDA® en association avec LENVIMA® vs le sunitinib (RR = 0,66* [IC à 95 % : 0,49 à 0,88; p = 0,0049†])
KEYTRUDA® en association avec LENVIMA®
23 %
(80 patients sur 355 ayant présenté un événement)Sunitinib
28 %
(101 patients sur 357 ayant présenté un événement)Durée médiane du suivi de la survie globale : 26,6 mois (intervalle : de 0,03+ à 46,13+ mois).1,4
La durée médiane de suivi de la survie globale était de n. a. (33,6, n. a.) pour KEYTRUDA® en association avec LENVIMA®, vs n. a. (n. a., n. a.) pour le sunitinib1,2
La dose recommandée de KEYTRUDA® chez les adultes est de 200 mg toutes les 3 semaines ou de 400 mg toutes les 6 semaines jusqu’à constatation d’une toxicité intolérable ou d’une progression de la maladie, ou jusqu’à 24 mois1.
Courbe de Kaplan-Meier de la survie globale dans l’étude KEYNOTE-581/CLEAR avec KEYTRUDA® en association avec LENVIMA® (n = 355) vs le sunitinib (n = 357)
 D’après les monographies de KEYTRUDA® et de LENVIMA®.
D’après les monographies de KEYTRUDA® et de LENVIMA®.Taux de réponse objective
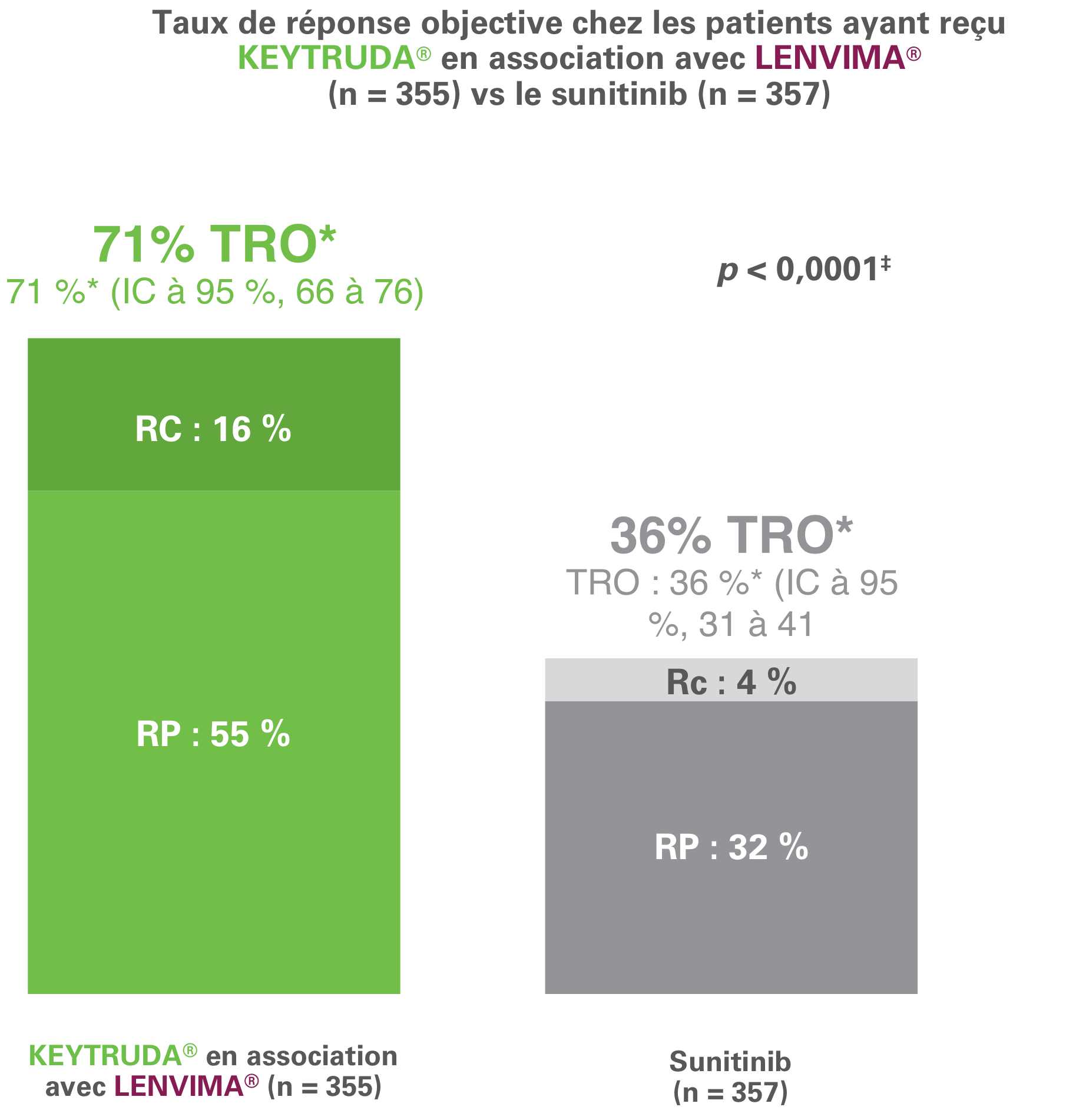
KEYTRUDA® en association avec LENVIMA® a entraîné des améliorations significatives quant au taux de réponse objective (paramètre d’évaluation secondaire), vs le sunitinib, chez les patients atteints d’un adénocarcinome rénal à un stade avancé ou métastatique et n’ayant jamais reçu de traitement à action générale contre un adénocarcinome rénal1,2
 D’après les monographies de KEYTRUDA® et de LENVIMA®.
D’après les monographies de KEYTRUDA® et de LENVIMA®.Durée de la réponse (paramètre d’évaluation exploratoire) pour KEYTRUDA® en association avec LENVIMA®, vs le sunitinib, chez des patients atteints d’un adénocarcinome rénal à un stade avancé ou métastatique1,2
Durée médiane de la réponse suggérée pour KEYTRUDA® en association avec LENVIMA®, vs le sunitinib, chez des patients ayant répondu au traitement dans l’étude KEYNOTE-581/CLEAR
 D’après les monographies de KEYTRUDA® et de LENVIMA®. Les tumeurs ont été évaluées au moyen des critères RECIST, version 1.1; seules les réponses confirmées ont été incluses dans le TRO.IC = intervalle de confiance; RR = rapport de risque; MSKCC = Memorial Sloan Kettering Cancer Center.
D’après les monographies de KEYTRUDA® et de LENVIMA®. Les tumeurs ont été évaluées au moyen des critères RECIST, version 1.1; seules les réponses confirmées ont été incluses dans le TRO.IC = intervalle de confiance; RR = rapport de risque; MSKCC = Memorial Sloan Kettering Cancer Center.
*Basé sur le modèle des risques proportionnels de Cox, stratifié par région géographique et par catégorie de risque du MSKCC.
† Valeur de p bilatérale basée sur le test logarithmique par rangs stratifié, par rapport à une limite de 0,0411 pour la SSP, et de 0,0161 pour la SG, respectivement.
‡ Valeur de p bilatérale calculée à partir du test de Cochran-Mantel-Haenszel.§ Comprend une hypothyroïdie, une augmentation de l’hormone thyréotrope dans le sang et une hypothyroïdie secondaire.1
¶ Comprend une diarrhée et une gastroentérite.1
** Comprend les effets suivants : ulcère aphteux, douleur gingivale, glossite, glossodynie, ulcère buccal, inflammation des muqueuses, gêne buccale, vésicules de la muqueuse buccale, douleur buccale, douleur oropharyngée, inflammation pharyngée, stomatite.1
†† Comprend un inconfort abdominal, une douleur abdominale, une rigidité abdominale, une sensibilité abdominale, un malaise épigastrique, une douleur au bas de l’abdomen, une douleur dans le haut de l’abdomen.1
‡‡ Comprend une asthénie, une fatigue, une léthargie et un malaise.1
§§ Comprend une augmentation de l’alanine aminotransférase, une augmentation de l’aspartate aminotransférase, une augmentation de la bilirubine sanguine, une atteinte hépatique provoquée par un médicament, une augmentation des enzymes hépatiques, une insuffisance hépatique, une fonction hépatique anormale, une lésion hépatocellulaire, une hépatotoxicité, une hyperbilirubinémie, une hypertransaminasémie, une hépatite à médiation immunitaire, une hausse des paramètres des tests de la fonction hépatique, une lésion hépatique, une augmentation du taux de transaminases, une augmentation des gamma-glutamyltransférases.1
¶¶ Comprend une diminution de l’appétit et une satiété précoce.1
*** Comprend une arthralgie, une arthrite, une douleur au dos, des douleurs osseuses, des douleurs mammaires, une douleur musculosquelettique thoracique, des malaises musculosquelettiques, des douleurs musculosquelettiques, une raideur musculosquelettique, une myalgie, une douleur au cou, une douleur thoracique non cardiaque, une douleur aux extrémités, une douleur à la mâchoire1
††† Comprend une hémoglobinurie, un syndrome néphrotique et une protéinurie1.
‡‡‡ Comprend une atteinte rénale aiguë, une azotémie, une hausse de la créatininémie, une diminution de la clairance rénale de la créatinine, une hypercréatininémie, une insuffisance rénale, un dysfonctionnement rénal, une oligurie, une diminution du débit de filtration glomérulaire et une néphropathie toxique.1
§§§ Comprend une éruption cutanée dans la région génitale, une éruption cutanée au point de perfusion, une éruption cutanée pénienne, une éruption cutanée périnéale, une éruption cutanée, une éruption érythémateuse, une éruption maculaire, une éruption maculopapuleuse, une éruption papuleuse, une éruption prurigineuse, une éruption pustuleuse.1
¶¶¶ Comprend un érythème palmaire, une érythrodysesthésie palmo-plantaire et un érythème plantaire.1
**** Comprend une hypertension essentielle, une hausse de la tension artérielle, une hausse de la tension artérielle diastolique, une hypertension, une crise hypertensive, une rétinopathie hypertensive, une tension artérielle instable1.
†††† Comprend tous les termes relatifs aux hémorragies. Les effets indésirables liés aux hémorragies survenus chez au moins un sujet dans l’un ou l’autre des groupes de traitement sont les suivants : hémorragie anale, rupture d’anévrisme, vésicule sanguine, anémie attribuable à la perte de sang, hématurie, hématome au point d’entrée du cathéter, microhémorragies cérébrales, hémorragie conjonctivale, contusion, diarrhée hémorragique, coagulation intravasculaire disséminée, ecchymose, épistaxis, hémorragie oculaire, hémorragie gastrique, gastrite hémorragique, saignement gingival, hémorragie des voies urinaires, hémothorax, hématémèse, hématome, hématochézie, hématurie, hémoptysie, hémorroïdes hémorragiques, tendance accrue aux ecchymoses, hématome au point d’injection, hémorragie au point d’injection, hémorragie intra-abdominale, hémorragie gastro-intestinale basse, syndrome de Mallory-Weiss, méléna, pétéchie, hémorragie rectale, hémorragie rénale, hémorragie rétropéritonéale, hémorragie de l’intestin grêle, hémorragies linéaires sous-unguéales, hématome sous-cutané, hématome sous-dural, hémorragie méningée, purpura thrombopénique thrombotique, hémorragie tumorale, hématome traumatique, hémorragie digestive haute1.Profil d’innocuité démontré chez les patients traités par KEYTRUDA® en association avec LENVIMA®
Effets indésirables survenus chez ≥ 20 % des patients atteints d’un adénocarcinome rénal à un stade avancé ou métastatique
D’après la monographie de KEYTRUDA® et LENVIMA®.Effet indésirableKEYTRUDA® en association avec LENVIMA®
(N=352)Sunitinib
(N=340)Tous les grades
(%)Grades 3–4
(%)Tous les grades
(%)Grades 3–4
(%)Hypothyroïdie§571320Diarrhée¶6210506Stomatite**432432Nausées363331Douleur abdominale††272181Vomissements263201Constipation251190Fatigue‡‡639568Hépatotoxicit駧259215Perte de poids30890,3Diminution de l’appétit¶¶414311Douleur musculosquelettique***584413Céphalées231161Protéinurie†††308133Atteinte rénale aigu뇇‡215162Dysphonie30040Éruption cutanée§§§375171Érythrodysesthésie palmo-plantaire¶¶¶294384Hypertension****56294320Événements hémorragiques††††275264- Parmi les patients traités avec KEYTRUDA® en association avec LENVIMA®, 37 % ont abandonné définitivement le traitement (soit KEYTRUDA® ou LENVIMA® ou les deux) en raison d’un effet indésirable : 29 % ont cessé de prendre KEYTRUDA® seulement, 26 % ont cessé de prendre LENVIMA® seulement et 13 % ont cessé de prendre les deux médicaments.
- Les effets indésirables les plus courants (≥ 2 %) ayant entraîné l’abandon définitif de KEYTRUDA®, de LENVIMA® ou des deux médicaments étaient les suivants : pneumonite (3 %), infarctus du myocarde (3 %), hépatotoxicité (3 %), atteinte rénale aiguë (3 %), éruption cutanée (3 %) et diarrhée (2 %).
- Des effets indésirables mortels liés au traitement sont survenus chez 4,3 % des patients traités avec KEYTRUDA® en association avec LENVIMA®.
- Ces effets comprenaient l’arrêt cardiorespiratoire (0,9 %) et la septicémie (0,9 %). Il y a eu un cas signalé (0,3 %) pour chacun des effets mortels suivants : arythmie, hépatite auto-immune, dyspnée, crise hypertensive, hausse de la créatininémie, syndrome de défaillance multiviscérale, syndrome myasthénique, myocardite, néphrite, pneumonite, anévrisme rupturé et hémorragie méningée.
- Des effets indésirables graves liés au traitement sont survenus chez 51 % des patients traités avec KEYTRUDA® en association avec LENVIMA®.
- Les effets indésirables graves survenus chez au moins 2 % des patients traités avec KEYTRUDA® en association avec LENVIMA® étaient les suivants : événements hémorragiques (5 %), diarrhée (4 %), hypertension (3 %), infarctus du myocarde (3 %), pneumonite (3 %), vomissements (3 %), atteinte rénale aiguë (2 %), insuffisance surrénalienne (2 %), dyspnée (2 %) et pneumonie (2 %).
Obtenez des conseils sur la prise en charge des effets indésirables liés à KEYTRUDA®.Aller à la page sur la prise en charge des effets indésirablesTéléchargez ce guide pour obtenir des conseils sur la prise en charge des effets indésirables chez les patients traités par KEYTRUDA® en association avec LENVIMA®.
Aidez vos patients prenant KEYTRUDA® en association avec LENVIMA® à faire le suivi de leurs effets indésirables en leur remettant ce journal personnel.
§ Comprend une hypothyroïdie, une augmentation de l’hormone thyréotrope dans le sang et une hypothyroïdie secondaire.1
¶ Comprend une diarrhée et une gastroentérite.1
** Comprend les effets suivants : ulcère aphteux, douleur gingivale, glossite, glossodynie, ulcère buccal, inflammation des muqueuses, gêne buccale, vésicules de la muqueuse buccale, douleur buccale, douleur oropharyngée, inflammation pharyngée, stomatite.1
†† Comprend un inconfort abdominal, une douleur abdominale, une rigidité abdominale, une sensibilité abdominale, un malaise épigastrique, une douleur au bas de l’abdomen, une douleur dans le haut de l’abdomen.1
‡‡ Comprend une asthénie, une fatigue, une léthargie et un malaise.1
§§ Comprend une augmentation de l’alanine aminotransférase, une augmentation de l’aspartate aminotransférase, une augmentation de la bilirubine sanguine, une atteinte hépatique provoquée par un médicament, une augmentation des enzymes hépatiques, une insuffisance hépatique, une fonction hépatique anormale, une lésion hépatocellulaire, une hépatotoxicité, une hyperbilirubinémie, une hypertransaminasémie, une hépatite à médiation immunitaire, une hausse des paramètres des tests de la fonction hépatique, une lésion hépatique, une augmentation du taux de transaminases, une augmentation des gamma-glutamyltransférases.1
¶¶ Comprend une diminution de l’appétit et une satiété précoce.1
*** Comprend une arthralgie, une arthrite, une douleur au dos, des douleurs osseuses, des douleurs mammaires, une douleur musculosquelettique thoracique, des malaises musculosquelettiques, des douleurs musculosquelettiques, une raideur musculosquelettique, une myalgie, une douleur au cou, une douleur thoracique non cardiaque, une douleur aux extrémités, une douleur à la mâchoire1
††† Comprend une hémoglobinurie, un syndrome néphrotique et une protéinurie1.
‡‡‡ Comprend une atteinte rénale aiguë, une azotémie, une hausse de la créatininémie, une diminution de la clairance rénale de la créatinine, une hypercréatininémie, une insuffisance rénale, un dysfonctionnement rénal, une oligurie, une diminution du débit de filtration glomérulaire et une néphropathie toxique.1
§§§ Comprend une éruption cutanée dans la région génitale, une éruption cutanée au point de perfusion, une éruption cutanée pénienne, une éruption cutanée périnéale, une éruption cutanée, une éruption érythémateuse, une éruption maculaire, une éruption maculopapuleuse, une éruption papuleuse, une éruption prurigineuse, une éruption pustuleuse.1
¶¶¶ Comprend un érythème palmaire, une érythrodysesthésie palmo-plantaire et un érythème plantaire.1
**** Comprend une hypertension essentielle, une hausse de la tension artérielle, une hausse de la tension artérielle diastolique, une hypertension, une crise hypertensive, une rétinopathie hypertensive, une tension artérielle instable1.
†††† Comprend tous les termes relatifs aux hémorragies. Les effets indésirables liés aux hémorragies survenus chez au moins un sujet dans l’un ou l’autre des groupes de traitement sont les suivants : hémorragie anale, rupture d’anévrisme, vésicule sanguine, anémie attribuable à la perte de sang, hématurie, hématome au point d’entrée du cathéter, microhémorragies cérébrales, hémorragie conjonctivale, contusion, diarrhée hémorragique, coagulation intravasculaire disséminée, ecchymose, épistaxis, hémorragie oculaire, hémorragie gastrique, gastrite hémorragique, saignement gingival, hémorragie des voies urinaires, hémothorax, hématémèse, hématome, hématochézie, hématurie, hémoptysie, hémorroïdes hémorragiques, tendance accrue aux ecchymoses, hématome au point d’injection, hémorragie au point d’injection, hémorragie intra-abdominale, hémorragie gastro-intestinale basse, syndrome de Mallory-Weiss, méléna, pétéchie, hémorragie rectale, hémorragie rénale, hémorragie rétropéritonéale, hémorragie de l’intestin grêle, hémorragies linéaires sous-unguéales, hématome sous-cutané, hématome sous-dural, hémorragie méningée, purpura thrombopénique thrombotique, hémorragie tumorale, hématome traumatique, hémorragie digestive haute1.
Références :
- Merck Canada Inc. Monographie de KEYTRUDA®, 21 mars 2024.
- Eisai Limitée. Monographie de LENVIMA®, 19 juillet 2023.
- Canil C et al. Management of advanced kidney cancer: Kidney Cancer Research Network of Canada (KCRNC) consensus update 2021. Can Urol Assoc J. 2021;15(4):84‒97.
- Le Conseil médical du Canada. Analyse de laboratoire – Valeurs de référence. Accessible à l’adresse https://mcc.ca/fr/examens-et-evaluations/ressources-pour-aider-a-la-preparation-dun-examen/valeurs-de-reference/. Consulté le 19 avril 2023.
- NCCN Clinical Practice Guidelines in Oncology. Kidney Cancer, Version 2.2024.
- Motzer R et al. Lenvatinib plus Pembrolizumab or Everolimus for Advanced Renal Cell Carcinoma. N Engl J Med. 2021;384(14):1289-1300. doi: 10.1056/NEJMoa2035716
CA-KLH-00055

