KEYTRUDA® a 2 indications dans le traitement du CSTN, et son profil d’efficacité et d’innocuité a été établi dans le cadre de 2 études pivots menées auprès d’un total de 1 449 patients. Découvrez quand envisager KEYTRUDA® chez vos patients admissibles atteints de CSTN1.
KEYTRUDA® est indiqué :
Comme traitement néoadjuvant, en association avec une chimiothérapie, des adultes atteints d’un cancer du sein triple négatif (CSTN) de stade précoce à haut risque, puis comme traitement adjuvant, en monothérapie, après la chirurgie1.
Pour le traitement, en association avec une chimiothérapie, des adultes atteints d’un cancer du sein triple négatif (CSTN) non résécable, localement récidivant ou métastatique, qui n’ont jamais reçu de chimiothérapie pour traiter une maladie métastatique et dont les tumeurs expriment le PD-L1 (score combiné positif [SCP] ≥ 10), tel que déterminé par un test validé1.
Lignes directrices de pratique clinique en oncologie du NCCN (NCCN Guidelines®†) pour le cancer du sein2
Maladie non résécable récidivante (localement) ou de stade IV (M1) :
- L’association pembrolizumab + chimiothérapie (paclitaxel lié à l’albumine, paclitaxel ou association gemcitabine + carboplatine) est recommandée comme traitement de première intention pour le traitement du cancer du sein triple négatif dont les tumeurs expriment le PD-L1 (SCP ≥ 10).
CSTN de stade précoce à haut risque :
- Traitement préopératoire par l’association pembrolizumab + carboplatine + paclitaxel, suivi d’un traitement préopératoire par l’association pembrolizumab + cyclophosphamide + doxorubicine ou épirubicine, suivi d’un traitement adjuvant par le pembrolizumab comme schéma thérapeutique privilégié.
En savoir plus sur les recommandations du NCCN (NCCN Guidelines).
Études cliniques
ÉTUDE KEYNOTE-355 (étude clinique sur le CSTN non résécable, localement récidivant ou métastatique)
ÉTUDE KEYNOTE-355Vidéo sur l’étude KEYNOTE-355
ConsulterÉTUDE KEYNOTE-522 (étude clinique sur le CSTN de stade précoce à haut risque)
ÉTUDE KEYNOTE-522Vidéo sur l’étude KEYNOTE-522
ConsulterAnalyse des biomarqueurs
Pour être admissibles au traitement par KEYTRUDA®, les patients atteints d’un CSTN non résécable, localement récidivant ou métastatique doivent présenter une tumeur exprimant le PD-L1 (SCP ≥ 10).
Qu’est-ce que le CSTN?
Les cancers du sein triple négatifs (CSTN) sont définis par l’absence des récepteurs hormonaux ER et PR, et HER23.Des analyses de biomarqueurs pour les récepteurs ER, PR et HER2 sont nécessaires pour confirmer le statut du CSTN3.
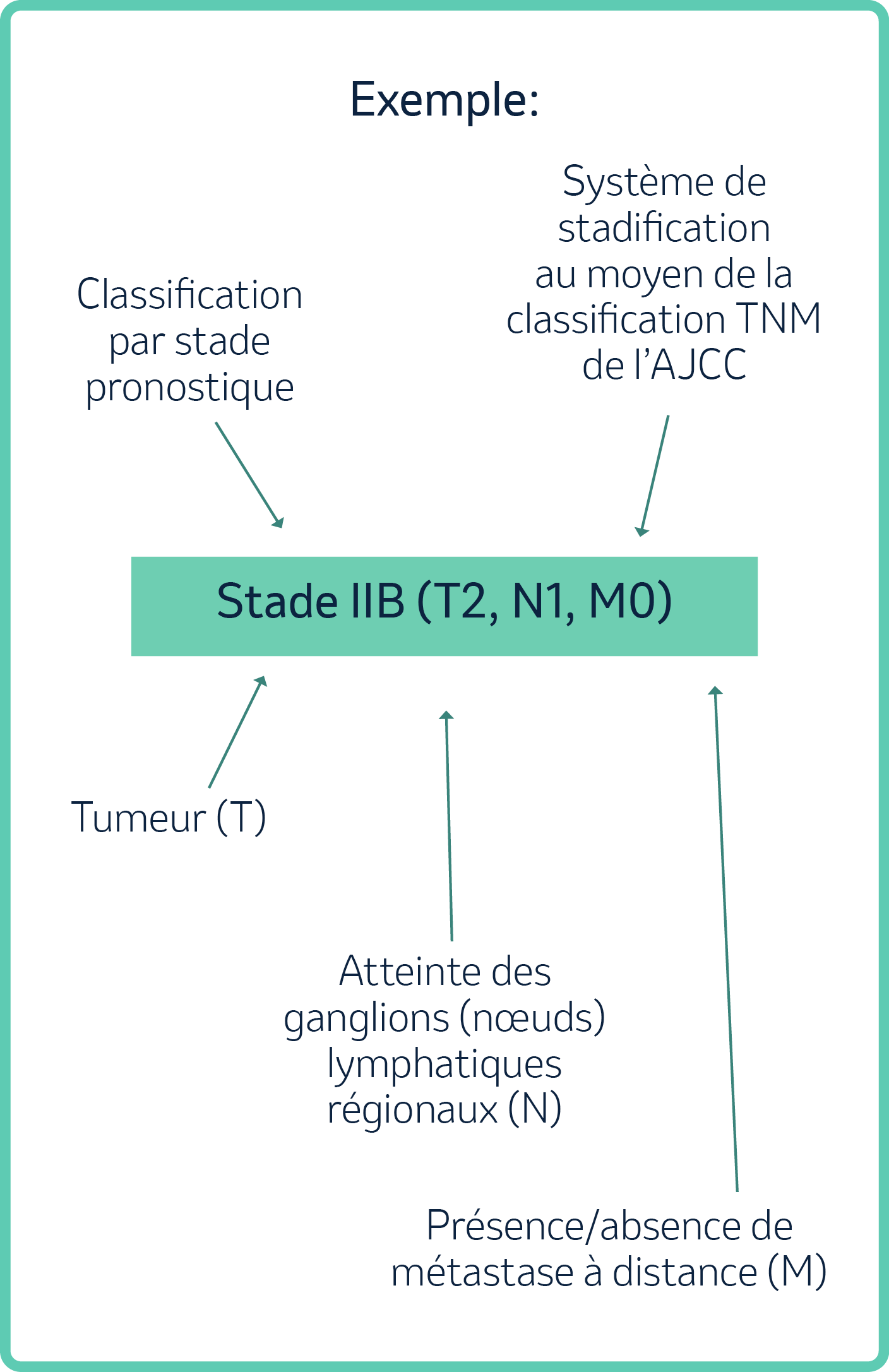
Stadification du cancer du sein selon l’AJCC
Le système de stadification le plus utile sur le plan clinique est la classification des tumeurs, des ganglions (nœuds) et des métastases (TNM), appelée système de stadification TNM de l’American Joint Committee on Cancer (AJCC)3.
- Il permet de classer les cancers selon la taille et l’étendue de la tumeur primaire (T), l’atteinte des ganglions (nœuds) lymphatiques régionaux (N) et la présence ou de l’absence de métastases à distance (M)3.
- Les sous-groupes T, N des stades I à IV sont désignés par des lettres majuscules conformément à la définition des regroupements des stades de l’emplacement du cancer et sont utilisés pour élargir les regroupements principaux afin de fournir des données pronostiques plus précises3.
Anatomie du cancer du sein
Corrélation anatomique de la stadification du cancer du sein*3

* La description anatomique liée à la stadification a été simplifiée. Pour une description complète des stades anatomiques du cancer du sein, y compris les sous-stades, voir le manuel de stadification du cancer de l’AJCC.
Dans la dernière édition du manuel de stadification de l’American Joint Committee on Cancer (AJCC), un changement majeur dans la stadification du cancer du sein consistait à incorporer le statut à l’égard des biomarqueurs (HER2, ER et PR) ainsi que le grade de la tumeur relativement aux catégories anatomiques T, M et N3.
AJCC = American Joint Committee on Cancer; ER = récepteur des œstrogènes; HER2 = récepteur 2 du facteur de croissance épidermique humain; NCCN = National Comprehensive Cancer Network®†; PR = récepteur de la progestérone; CSTN = cancer du sein triple négatif.
†Toutes les autres marques de commerce sont détenues par leur(s) propriétaire(s) respectif(s).
Références :
1. Monographie de KEYTRUDA®. Merck Canada Inc., 6 février 2024.
2. NCCN®. Lignes directrices de pratique clinique en oncologie du NCCN (NCCN Guidelines®) pour le cancer du sein, 23 mars 2023.
3. American Joint Committee on Cancer (AJCC). Cancer Staging Manual 8th edition. doi:10.1007/978-3-319-40618-3.
CA-OBR-00006
